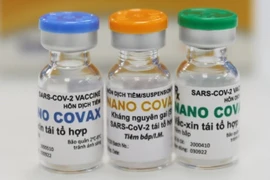
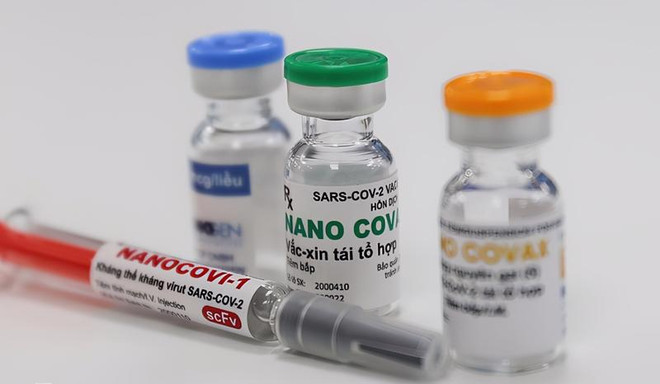Hanoï, 30 août (VNA) - La Société de biotechnologies pharmaceutiques Nanogen (Nanogen Pharmaceutical Biotechnology JSC) a été invitée à fournir plus de données pour examen avant qu'un certificat d'enregistrement de circulation conditionnelle pour son vaccin Nano Covax puisse être délivré.
La demande a été faite par le Conseil consultatif pour l'enregistrement de la circulation des médicaments et des ingrédients médicinaux à l'issue d'une réunion tenue le 29 août.
Dans un communiqué de presse, le Conseil a déclaré qu'il et les unités concernées avaient soigneusement examiné la demande, ajoutant que le dossier avait été évalué par le sous-comité juridique à deux reprises ; par le sous-comité qualité à quatre reprises et par le sous-comité pharmacologie et clinique trois fois.
Le Conseil consultatif a pris acte des résultats obtenus pour la demande de certificat d'enregistrement de circulation du vaccin Nano Covax qui avait été évalué par les sous-comités d'experts, et accepté par le Conseil national d'éthique. Dans le même temps, le Conseil consultatif a demandé à la société de continuer à compléter et à clarifier certains contenus concernant la qualité des applications et les dossiers pharmacologiques et cliniques.
Concernant les dossiers pharmacologiques et cliniques, le Conseil a demandé plus d'informations concernant la sécurité, l'immunogénicité et l'effet protecteur.
Plus précisément, la société doit ajouter et mettre à jour des données sur la sécurité de tous les sujets qui ont été vaccinés avec au moins une dose du vaccin jusqu'à présent et expliquer clairement les cas d'événements indésirables graves (EIG).
En ce qui concerne l'effet de protection, il est nécessaire que l'entreprise se coordonne avec l'équipe de recherche pour analyser et discuter de la relation entre l'immunogénicité du vaccin et l'efficacité de la protection d'au moins 50 % (selon les directives de l'Organisation mondiale de la santé).
Le vaccin Nano Covax a été développé par la Société de biotechnologies pharmaceutiques Nanogen, depuis mai 2020, sur la base de la technologie des protéines recombinantes. Avant l'essai de la 3e phase au 19 juillet, ce vaccin a subi 2 phases d'essais cliniques : 1ère phase depuis le 18 décembre 2020 ; la 2e phase depuis le 26 février 2021 ; et la 3e phase depuis le 11 juin 2021.
Les essais de troisième phase, utilisant uniquement les doses de 25 mcg, couvrent 13.000 volontaires âgés de 18 à 75 ans dans tout le pays. - VNA